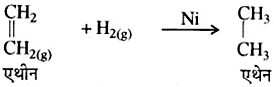RBSE BSER CLASS X SCIENCE LESSON 6 CHEMICAL REACTION & CATALYST
RBSE BSER CLASS X SCIENCE LESSON 6 CHEMICAL REACTION & CATALYST
रासायनिक अभिक्रियाएँ एवं उत्प्रेरक(M.Sc. M.A. B.Ed.)
SCIENCE EDUCATOR,
These Solutions for Class 10 Science Chapter 6 रासायनिक अभिक्रियाएँ एवं उत्प्रेरक are part of Solutions for Class 10 Science. Here we have given Rajasthan Board RBSE Class 10 Science Chapter 6 रासायनिक अभिक्रियाएँ एवं उत्प्रेरक
| Board | RBSE |
| Textbook | SCERT, Rajasthan |
| Class | Class 10 |
| Subject | Science |
| Chapter | Chapter 6 |
| Chapter Name | रासायनिक अभिक्रियाएँ एवं उत्प्रेरक |
| Number of Questions Solved | 144 |
| Category | RBSE CLASS X |
आपकी पाठ्य पुस्तक के प्रश्न
बहुचयनात्मक प्रश्न
RBSE BSER CLASS X SCIENCE LESSON 6 CHEMICAL REACTION & CATALYST1. FeCl3 का FeCl2 में परिवर्तन कहलाता है
(क) ऑक्सीकरण
(ख) अपचयन
(ग) अपघटन।
(घ) संयुग्मन
2. एक पदार्थ दो छोटे सरल अणुओं में टूटता है तो अभिक्रिया होगी|
(क) अपघटनीय
(ख) विस्थापन
(ग) ऑक्सीकरण
(घ) संयुग्मन
3. इलेक्ट्रॉन त्यागने वाले पदार्थ कहलाते हैं
(क) ऑक्सीकारक
(ख) उत्प्रेरक
(ग) अपचायक
(घ) कोई नहीं
4. दोनों दिशाओं में होने वाली अभिक्रियाएँ हैं|
(क) ऑक्सीकरण
(ख) अपचयन
(ग) अनुक्रमणीय
(घ) उत्क्रमणीय
5. अभिक्रिया के वेग को बढ़ाने वाले होते हैं
(क) उत्प्रेरक
(ख) ऑक्सीकारक
(ग) अपचायक
(घ) कोई नहीं
6. एन्जाइम होते हैं
(क) ऋणात्मक उत्प्रेरक
(ख) धनात्मक उत्प्रेरक
(ग) स्वतः उत्प्रेरक
(घ) जैव उत्प्रेरक
7. 2Mg + O2 → 2 MgO
इस अभिक्रिया में मैग्नीशियम धातु हो रहा है
(क) ऑक्सीकृत।
(ख) अपचयित
(ग) अपघटित
(घ) विस्थापित
8. उत्क्रमणीय अभिक्रियाओं के लिए किस चिन्ह का प्रयोग किया जाता है
(क) →
(ख) ↑
(ग) ↓
(घ) ⇔
9. वह अभिक्रिया जो बनने वाले उत्पाद से ही उत्प्रेरित हो जाती है, कहलाती
(क) जैव रासायनिक
(ख) उत्क्रमणीय
(ग) स्वतः उत्प्रेरित
(घ) अनुत्क्रमणीय
10. ऊष्माक्षेपी अभिक्रिया में ऊष्मा
(क) निकलती है।
(ख) अवशोषित होती है।
(ग) विलेय होती है।
(घ) इनमें से कोई नहीं
उत्तरमाला- 1. (ख) 2. (क) 3. (ग) 4. (घ) 5. (क) 6. (घ) 7. (क) 8. (घ) 9. (ग) 10. (क)
अतिलघूत्तरात्मक प्रश्न
प्रश्न 11. रासायनिक परिवर्तन से आप क्या समझते हैं ?
उत्तर- वह परिवर्तन जिसमें पदार्थ के रासायनिक गुण तथा संघटन में परिवर्तन होकर नया पदार्थ बनता है, उसे रासायनिक परिवर्तन कहते हैं।
उदाहरण- कोयले को जलाने पर CO2 गैस का बनना।
C(s) + O2(g) → CO2(g)
प्रश्न 12. वनस्पति तेल को वनस्पति घी में परिवर्तित करने वाले उत्प्रेरक का नाम बताइये।।
उत्तर- वनस्पति तेल को वनस्पति घी में परिवर्तित करने के लिए निकेल (Ni) उत्प्रेरक का प्रयोग किया जाता है।
प्रश्न 13. उत्प्रेरण कितने प्रकार का होता है? नाम लिखें।
उत्तर- उत्प्रेरण मुख्यतः चार प्रकार का होता है-
- धनात्मक उत्प्रेरण
- ऋणात्मक उत्प्रेरण
- स्वतः उत्प्रेरण
- जैव उत्प्रेरण।
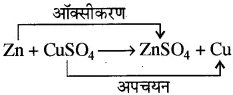
प्रश्न 14. Zn + CuSO4 → ZnSO4 + Cu
यह किस प्रकार की अभिक्रिया का उदाहरण है?
उत्तर- यह एक विस्थापन तथा रेडॉक्स अभिक्रिया है।
प्रश्न 15. रेडॉक्स अभिक्रिया का एक उदाहरण दें।
उत्तर-
प्रश्न 16. उत्क्रमणीय अभिक्रिया किसे कहते हैं ?
उत्तर- वह अभिक्रिया जो दोनों दिशाओं में होती है अर्थात् जिसमें अभिकारक से उत्पाद तथा उत्पाद से पुनः अभिकारक का निर्माण होता है, उसे उत्क्रमणीय अभिक्रिया कहते हैं। उदाहरण
Na2(g) + 3H2(g) ⇔ 2NH3(g)
प्रश्न 17. उत्प्रेरक वर्धक व उत्प्रेरक विष का क्या कार्य है?
उत्तर- उत्प्रेरक वर्धक, उत्प्रेरक की क्रियाशीलता बढ़ाते हैं जबकि उत्प्रेरक विष से उत्प्रेरक की क्रियाशीलता कम हो जाती है।
प्रश्न 18. अम्ल व क्षार की परस्पर अभिक्रिया कौनसी अभिक्रिया कहलाती है?
उत्तर-
अम्ल व क्षार की परस्पर अभिक्रिया से लवण तथा जल बनता है तथा इस अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं।
प्रश्न 19. वेग के आधार पर अभिक्रिया कितने प्रकार की होती है?
उत्तर-
वेग के आधार पर अभिक्रिया दो प्रकार की होती है-
- तीव्र अभिक्रियाएँ
- मंद अभिक्रियाएँ।
प्रश्न 20. ताप अपघटन अभिक्रिया का उदाहरण दें।
उत्तर-
कैल्सियम कार्बोनेट का विघटन एक ताप अपघटन या ऊष्मीय अपघटन अभिक्रिया है।
CaCO3 कैल्सियम कार्बोनेट →Δ→ CaO + CO2↑ कैल्सियम ऑक्साइड
प्रश्न 21. किसी अभिक्रिया में उत्प्रेरक का क्या कार्य होता है?
उत्तर-
उत्प्रेरक रासायनिक अभिक्रिया के वेग में वृद्धि या कमी कर देते हैं। लेकिन स्वयं अपरिवर्तित रहते हैं।
प्रश्न 22. रासायनिक अभिक्रिया के संतुलन का आधारभूत सिद्धांत क्या है?
उत्तर-
रासायनिक अभिक्रिया के समीकरण का संतुलन द्रव्यमान संरक्षण के नियम के आधार पर किया जाता है, जिसके अनुसार किसी रासायनिक अभिक्रिया में न तो द्रव्यमान का निर्माण होता है और न ही नष्ट। अतः सम्पूर्ण अभिक्रिया में द्रव्यमान संरक्षित रहता है।
23. रेडॉक्स अभिक्रिया किसे कहते हैं ?
उत्तर-
वह अभिक्रिया जिसमें एक पदार्थ ऑक्सीकृत तथा दूसरा पदार्थ अपचयित होता है अर्थात् ऑक्सीकरण व अपचयन अभिक्रियाएँ साथ-साथ चलती हैं, उसे रेडॉक्स या उपापचयी अभिक्रिया कहते हैं।
प्रश्न 24. कोयले का दहन कौन सी अभिक्रिया है?
उत्तर-
कोयले का दहन एक संयुग्मन अभिक्रिया है, किन्तु इस अभिक्रिया में कोयले का ऑक्सीकरण भी हो रहा है। अतः यह एक ऑक्सीकरण अभिक्रिया भी है।
प्रश्न 25. प्रबल अम्ल व प्रबल क्षार के मध्य अभिक्रिया कराने पर विलयन की pH कितनी होगी?
उत्तर-
समान सान्द्रता के प्रबल अम्ल व प्रबल क्षार के मध्य अभिक्रिया कराने पर विलयन की pH 7 होगी क्योंकि विलयन उदासीन हो जाएगा।
लघूत्तरात्मक प्रश्न
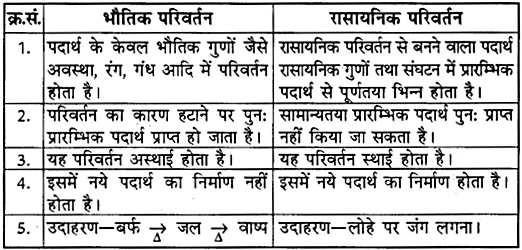
प्रश्न 26. भौतिक एवं रासायनिक परिवर्तन में अंतर लिखें।
उत्तर-
भौतिक एवं रासायनिक परिवर्तन में निम्नलिखित अन्तर हैं
प्रश्न 27. संयुग्मन व अपघटनीय अभिक्रियाओं को एक-एक उदाहरण के साथ लिखें।
उत्तर-
(i) संयुग्मन अभिक्रियाएँ- वे रासायनिक अभिक्रियाएँ जिनमें दो या दो से अधिक अभिकारक आपस में संयोग करके एक ही उत्पाद बनाते हैं, उन्हें संयुग्मन अभिक्रियाएँ कहते हैं। इन अभिक्रियाओं में अभिकारकों के मध्य नये बंधों का निर्माण होता है।
इन अभिक्रियाओं में अभिकारकों का साधारण योग होता है अतः इन्हें योगात्मक या संयोजन अभिक्रिया कहा जाता है।
उदाहरण- कैल्सियम ऑक्साइड (बिना बुझा चूना) का जल के साथ तीव्रता से अभिक्रिया करके कैल्सियम हाइड्रॉक्साइड (बुझा हुआ चूना) बनाना।।
CaO(s) + H2O(l) → Ca(OH)2(aq)
(ii) अपघटनीय अभिक्रियाएँ-वे रासायनिक अभिक्रियाएँ जिनमें एक अभिकारक अपघटित होकर (टूट कर) दो या दो से अधिक उत्पाद बनाता है, उन्हें अपघटनीय अभिक्रियाएँ कहते हैं। इनमें अभिकारकों के मध्य बने हुए बंध टूटते हैं। जिससे छोटे अणुओं का निर्माण होता है।
उदाहरण- CaCO3 (कैल्सियम कार्बोनेट) को गर्म करने पर CaO तथा CO2 गैस बनती है।
CaCO3(s)(चूना पत्थर) → CaO(s) + CO2(g)(कैल्सियम ऑक्साइड)
प्रश्न 28. AgNO3 + KCl → AgCI + KNO3
उपरोक्त अभिक्रिया किस प्रकार की है? नाम लिखें तथा समझाएँ।
उत्तर-
यह एक द्विविस्थापन अभिक्रिया है जिसमें दोनों अभिकारकों के परमाणु या परमाणुओं का समूह आपस में विस्थापित होते हैं तथा नये यौगिक बनते हैं। अभिक्रिया–
AgNO3 + KCl → AgCl + KNO3
में AgNO3, के NO3– आयन KCl के Cl– आयनों को विस्थापित कर रहे हैं जिससे सिल्वर क्लोराइड (AgCl) तथा पोटेशियम नाइट्रेट (KNO3) बन रहे हैं।
प्रश्न 29. ऑक्सीकरण व अपचयन को इलेक्ट्रॉनिक आदान-प्रदान के आधार पर समझाइए।
उत्तर-
ऑक्सीकरण-ऐसी अभिक्रिया जिसमें परमाणु, आयन या अणु इलेक्ट्रॉन त्यागता है, उसे ऑक्सीकरण कहते हैं। इसमें इलेक्ट्रॉनों की संख्या कम होती है। उदाहरण
K → K+ + e–
Fe2+ → Fe3+ + e–
2Cl– → Cl2 + 2e–
यहाँ पोटेशियम परमाणु एक e– त्याग कर K+ धनायन में, फेरस (Fe2+)
आयन एक और e– त्याग कर (Fe3+) फेरिक आयन में तथा क्लोराइड (Cl–) आयन e– त्याग कर उदासीन क्लोरीन परमाणु में ऑक्सीकृत होता है। इन अभिक्रियाओं से ज्ञात होता है कि ऑक्सीकरण की क्रिया में उदासीन परमाणु धनायन बनाता है या धनायन पर आवेश बढ़ता है या ऋणायन से उदासीन परमाणु बनता है।
अपचयन-वह अभिक्रिया जिसमें परमाणु, आयन या अणु द्वारा इलेक्ट्रॉन ग्रहण किया जाता है, उसे अपचयन कहते हैं। इसमें इलेक्ट्रॉनों की संख्या में वृद्धि होती है। उदाहरण
Br + e– → Br–
MnO4– + e– → MnO4-2
Mg+2 + 2e– → Mg
यहाँ ब्रोमीन परमाणु एक e– ग्रहण कर ब्रोमाइड आयन (Br–), मैग्नेट आयन (MnO4–), एक e ग्रहण कर परमैंग्नेट आयन (MnO4-2) तथा मैग्नीशियम आयन (Mg+2) दो e– ग्रहण कर उदासीन Mg परमाणु में अपचयित हो रहे हैं। अतः अपचयन अभिक्रिया में उदासीन परमाणु से ऋणायन बनता है या ऋणायन पर आवेश बढ़ता है या धनायन से उदासीन परमाणु बनता है।
प्रश्न 30. उत्प्रेरक कितने प्रकार के होते हैं? लिखें।
उत्तर-
(a) क्रिया के आधार पर उत्प्रेरक चार प्रकार के होते हैं
- धनात्मक उत्प्रेरक-उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को बढ़ाते हैं, उन्हें धनात्मक उत्प्रेरक कहते हैं।
2SO2 + O2 →NO→ 2SO3 - ऋणात्मक उत्प्रेरक-उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को कम करते हैं, उन्हें ऋणात्मक उत्प्रेरक कहते हैं।
2H2O2 →ग्लिसरॉल→ 2H2O + O2 - स्वतः उत्प्रेरक-जब किसी रासायनिक अभिक्रिया में बना उत्पाद ही उत्प्रेरक का कार्य करता है अर्थात् अभिक्रिया के वेग को बढ़ा देता है तो उस उत्पाद को स्वतः उत्प्रेरक कहते हैं।
उदाहरण
CH3COOC2H5 एथिल एसीटेट + H2O ⇔ CH3COOH एसीटिक अम्ल + C2H5OH एथेनॉल
इस अभिक्रिया में CH3COOH स्वतः उत्प्रेरक है। - जैव उत्प्रेरक-वे पदार्थ जो जैव रासायनिक अभिक्रियाओं के वेग को बढ़ाते हैं, उन्हें जैव उत्प्रेरक कहते हैं। इन्हें एन्जाइम भी कहते हैं।
उदाहरण
NH2CONH2 यूरिया + H2O → यूरिएज → 2NH3 + CO2
(b) भौतिक अवस्था के आधार पर उत्प्रेरक दो प्रकार के होते हैं
- समांगी उत्प्रेरक-जब किसी रासायनिक अभिक्रिया में उत्प्रेरक, अभिकारक एवं उत्पाद तीनों की भौतिक अवस्था समान होती है तो उत्प्रेरक समांगी उत्प्रेरक कहलाता है।
उदाहरण-
CH3C00CH3(l) मेथिल एसीटेट + H2O(l) →HCl(aq)→ CH3COOH(aq) एसीटिक अम्ल + CH3OH(aq) मेथिल एल्कोहॉल
2SO2(g) + O2(g) सल्फर डाईऑक्साइड → NO(g)→ 2SO3(g) सल्फर ट्राईऑक्साइड - विषमांगी उत्प्रेरक-जब किसी रासायनिक अभिक्रियाओं में अभिकारक एवं उत्प्रेरक की भौतिक अवस्था भिन्न-भिन्न होती है तो इस अवस्था में उत्प्रेरक को विषमांगी उत्प्रेरक कहते हैं।
उदाहरण-
N2(g) + 3H2(g) →Fe(s) →2NH3(g)
वनस्पति तेल(l) + H2(g) →Ni(s)→ वनस्पति घी(s)
सूक्ष्म विभाजित निकल धातु (Ni) की उपस्थिति में वनस्पति तेलों का हाइड्रोजनीकरण करके वनस्पति घी बनाया जाता है। इस अभिक्रिया में तेल द्रव अवस्था में, H2 गैसीय अवस्था में, Ni तथा घी ठोस अवस्था में है।
प्रश्न 31. अपघटनीय अभिक्रियाएँ कितने प्रकार की होती हैं? वर्णन करें।
उत्तर-
अपघटनीय अभिक्रियाओं में एक अभिकारक अपघटित होकर दो या दो से अधिक उत्पाद बनाता है। अपघटनीय अभिक्रियाएँ तीन प्रकार की होती
(i) विद्युत अपघटन
(ii) ऊष्मीय अपघटन
(iii) प्रकाशीय अपघटन
(i) विद्युत अपघटन- जब किसी यौगिक की गलित या द्रव अवस्था में विद्युत धारा प्रवाहित की जाती है तो वह अपघटित होकर कैथोड तथा एनोड पर भिन्नभिन्न उत्पाद बनाता है, तो इस अभिक्रिया को विद्युत अपघटन कहते हैं। उदाहरणजल का विद्युत अपघटन करने पर हाइड्रोजन तथा ऑक्सीजन गैस बनती है।
2H2O(l) →विद्युत धारा→ 2H2(g) + O2(g)
2NaCl(aq) →विद्युत धारा→ 2Na(aq) + Cl2(ag)↑
(ii) ऊष्मीय अपघटन- इस अभिक्रिया में यौगिक को ऊष्मा देने पर वह छोटे अणुओं में टूट जाता है। उदाहरण-कैल्शियम कार्बोनेट को 473K ताप तक गर्म करने पर अपघटित होकर कैल्शियम ऑक्साइड तथा CO2 बनाता है।
CaCO3 →Δ→ CaO + CO2 ↑
(iii) प्रकाशीय अपघटन- प्रकाशीय अपघटन में यौगिक प्रकाश से ऊर्जा प्राप्त करके छोटे-छोटे अणुओं में टूट जाता है।
उदाहरण-
2HBr → H2↑ + Br2
प्रश्न 32. क्लोरोफार्म में कुछ मात्रा में एथिल एल्कोहॉल मिलाकर क्यों रखा जाता है?
उत्तर-
क्लोरोफार्म वायु की ऑक्सीजन से स्वतः ही ऑक्सीकृत होकर विषैली गैस फॉस्जीन बनाता है। इस अभिक्रिया के वेग को कम करने के लिए इसमें थोड़ी मात्रा में एथेनॉल (C2H5OH) मिला दिया जाता है।
2CHCl3 क्लोरोफॉर्म + O2 →C2H5OH→ 2COCl2 फॉस्जीन + 2HCl
यहाँ एथेनॉल अल्प मात्रा में बनी फॉस्जीन (COCl2) से क्रिया करके डाइएथिल कार्बोनेट तथा HCl बनाता है, जिससे अभिक्रिया धीमी हो जाती है।
2C2H5OH + COCl2 → (C2H5)2CO3 अविषाक्त + 2HCl.
प्रश्न 33. दुर्बल अम्ल व प्रबल क्षार से बने लवण का जलीय विलयन क्षारीय होता है। क्यों?
उत्तर-
दुर्बल अम्ल तथा प्रबल क्षार से बने लवण के जलीय विलयन में उपस्थित दुर्बल अम्ल पूर्णतः आयनित नहीं होता अर्थात् कुछ मात्रा में अवियोजित अवस्था में भी रहता है। अतः विलयन में अम्ल व क्षार के समान मोल होने पर भी प्रबल क्षार से प्राप्त OH- अधिक मात्रा में रहते हैं। अतः विलयन क्षारीय होता है। जिसकी pH 7 से अधिक होती है। उदाहरण
CH3COONa सोडियम एसीटेट + H2O → CH3COOH दुर्बल अम्ले (अल्प आयनित) + NaOH प्रबल क्षार (पूर्ण आयनित)
प्रश्न 34. क्या ये अभिक्रियाएँ संभव हैं? उत्तर कारण सहित लिखें।
(i) Cu + ZnSO4 → CuSO4 + Zn
(ii) Fe + CuSO4 → FeSO4 + Cu
उत्तर-
ये दोनों ही विस्थापन अभिक्रियाओं के उदाहरण हैं। विस्थापन अभिक्रियाओं में अधिक क्रियाशील तत्व, तुलनात्मक रूप से कम क्रियाशील तत्वों को विस्थापित करते हैं, लेकिन इसके विपरीत नहीं होता।
(i) यह अभिक्रिया सम्भव नहीं है क्योंकि Cu, Zn से कम क्रियाशील धातु है अतः यह Zn को विस्थापित नहीं कर सकता।
Cu + ZnSO4 → CuSO4 + Zn
(ii) यह अभिक्रिया सम्भव है क्योंकि Fe, Cu से अधिक क्रियाशील है। अतः यह Cu को विस्थापित करके FeSO4 तथा Cu बनाता है।
Fe + CuSO4 → FeSO4 + Cu
प्रश्न 35. निम्नलिखित अभिक्रियाओं में ऑक्सीकरण-अपचयन को पहचाहिए
- C + O2 → CO2
- Mg + Cl2 → MgCl2
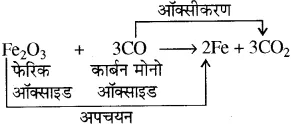
- ZnO + C → Zn + CO
- Fe2O3 + 3CO → 2Fe + 3CO2
उत्तर-
- C + O2 → CO2– इस अभिक्रिया में कार्बन का ऑक्सीजन के साथ संयोग हो रहा है अतः इसका ऑक्सीकरण हो रहा है, लेकिन O2 का अपचयन हो रहा है।
- Mg + Cl2 → MgCl2 -इस अभिक्रिया में मैग्नीशियम (Mg) का अधिक विद्युतऋणी तत्व क्लोरीन (Cl2) के साथ संयोग हो रहा है अतः इसका ऑक्सीकरण हो रहा है, लेकिन (Cl2) का अपचयन हो रहा है।
- ZnO + C → Zn + CO-इस अभिक्रिया में ZnO में से ऑक्सीजन निकल रही है अतः इसका अपचयन हो रहा है, लेकिन कार्बन का कार्बन मोनोऑक्साइड में ऑक्सीकरण हो रहा है।
- Fe2O3 + 3CO → 2Fe + 3CO2-इस अभिक्रिया में फेरिक ऑक्साइड (Fe2O3) का आयरन में अपचयन तथा कार्बन मोनोऑक्साइड (CO) का CO2 में ऑक्सीकरण हो रहा है।
उपरोक्त सभी अभिक्रियाओं में एक पदार्थ का ऑक्सीकरण तथा दूसरे का अपचयन हो रहा है अतः इन्हें रेडॉक्स अभिक्रियाएँ कहते हैं।
निबन्धात्मक प्रश्न
प्रश्न 36. रासायनिक अभिक्रियाएँ कितने प्रकार की होती हैं? वर्णन करें।
उत्तर-
रासायनिक अभिक्रिया-वह अभिक्रिया जिसमें उत्पाद का रासायनिक गुण तथा संघटने मूल पदार्थ से भिन्न होता है अर्थात् किसी पदार्थ में रासायनिक परिवर्तन होना रासायनिक अभिक्रिया कहलाता है। रासायनिक अभिक्रिया में अभिकारकों से उत्पादों का निर्माण होता है परन्तु पदार्थ का कुल द्रव्यमान संरक्षित रहता है।
उदाहरण- मैग्नीशियम के फीते का दहन
2Mg(s) + O2(g) → 2MgO(s) मैग्नीशियम ऑक्साइड (श्वेत चूर्ण)
रासायनिक अभिक्रियाएँ मुख्यतः चार प्रकार की होती हैं
(i) संयुग्मन अभिक्रियाएँ
(ii) विस्थापन अभिक्रियाएँ।
(iii) द्विविस्थापन अभिक्रियाएँ
(iv) अपघटनीय अभिक्रियाएँ
(i) संयुग्मन अभिक्रियाएँ या योगात्मक अभिक्रियाएँ- वे रासायनिक अभिक्रियाएँ जिनमें दो या दो से अधिक अभिकारक आपस में संयोग करके एक ही उत्पाद बनाते हैं उन्हें संयुग्मन अभिक्रियाएँ कहते हैं। इन अभिक्रियाओं में अभिकारकों के मध्य नये बंधों का निर्माण होता है।
उदाहरण- एथीन का हाइड्रोजनीकरण

(ii) विस्थापन अभिक्रियाएँ- वे रासायनिक अभिक्रियाएँ जिनमें एक अभिकारक में उपस्थित परमाणु या परमाणुओं का समूह दूसरे अभिकारक के परमाणु या परमाणुओं के समूह द्वारा विस्थापित होता है, उन्हें विस्थापन अभिक्रियाएँ कहते हैं। इन अभिक्रियाओं में अभिकारकों के बंध टूटते हैं तथा नये बंधों का निर्माण होता है।
उदाहरण- CuSO4 नीला (कॉपर सल्फेट) + Zn जिंक → ZnSO4 रंगहीन (जिंक सल्फेट) + Cu
(iii) द्विविस्थापन अभिक्रियाएँ- वे रासायनिक अभिक्रियाएँ जिनमें दोनों अभिकारकों के परमाणु या परमाणुओं के समूह आपस में विस्थापित होकर नये यौगिकों का निर्माण होता है, उन्हें द्विविस्थापन अभिक्रियाएँ कहते हैं। इनमें दोनों अभिकारकों के कुछ भाग आपस में विस्थापित होकर नए उत्पाद बनाते हैं।
उदाहरण-
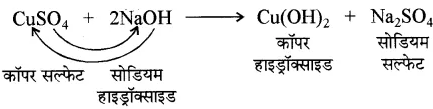
(iv) अपघटनीय अभिक्रियाएँ- वे अभिक्रियाएँ जिनमें एक अभिकारक अपघटित होकर दो या दो से अधिक उत्पाद बनाते हैं, उन्हें अपघटनीय अभिक्रियाएँ कहते हैं। अपघटनीय अभिक्रियाएँ तीन प्रकार की होती हैं
(a) विद्युत अपघटन
(b) ऊष्मीय अपघटन
(c) प्रकाशीय अपघटन
उदाहरण- 2NaCl(ag) →विद्युत अपघटन→ 2NaOH(aq) + Cl2(g)↑
प्रश्न 37. ऑक्सीकरण-अपचयन से क्या समझते हैं? उदाहरणों के साथ व्याख्या करें।
उत्तर-
ऑक्सीकरण तथा अपचयन को विभिन्न आधारों पर परिभाषित किया जाता है
- ऑक्सीजन के संयोग एवं विलोपन (वियोजन ) के आधार पर-किसी पदार्थ के साथ ऑक्सीजन का जुड़ना ऑक्सीकरण तथा ऑक्सीजन का निकलना अपचयन कहलाता है।
उदाहरण- ऑक्सीकरण
2Mg + O2 → 2MgO
S + O2 → SO2 सल्फर डाईऑक्साइड
अपचयन-
2KClO3 → 2KCl + 3O2 - हाइड्रोजन के संयोग तथा विलोपन के आधार पर-किसी पदार्थ में से हाइड्रोजन का निकलना ऑक्सीकरण तथा हाइड्रोजन का जुड़ना अपचयन कहलाता है।
उदाहरण- ऑक्सीकरण
2H2S + O2 → 2H2O + 2S
इस अभिक्रिया में H2S (हाइड्रोजन सल्फाइड) गैस सल्फर (S) में ऑक्सीकृत हो रही है।
CH3CH2OH एथेनैल →[O]→ CH3CHO + H2 एथेनॉल
अपचयन-
H2 + Cl2 → 2HCl
यहाँ क्लोरीन का HCl में अपचयन हो रहा है। - विद्युत धनी तत्त्वों के संयोग तथा विलोपन के आधार पर-वह अभिक्रिया जिसमें किसी पदार्थ में से विद्युत धनी तत्व (धन विद्युती तत्व) का निष्कासन होता है, उसे ऑक्सीकरण तथा विद्युत धनी तत्व का योग होता है, उसे अपचयन कहते हैं।
उदाहरण- ऑक्सीकरण
2KI + Cl2 → 2KCl + I2
H2S + Cl2 → 2HCl + S
इन अभिक्रियाओं में पोटेशियम आयोडाइड (KI) का आयोडीन (I2) में तथा H2S का सल्फर (S) में ऑक्सीकरण हो रहा है।
अपचयन-
Cl2 + Mg → MgCl2
यहाँ क्लोरीन (Cl2) का मैग्नीशियम क्लोराइड (MgCl2) में अपचयन हो रहा है। - विद्युतऋणी तत्वों के संयोग तथा विलोपन के आधार पर-वे अभिक्रियाएँ जिनमें किसी पदार्थ का विद्युतऋणी.तत्व के साथ संयोग होता है, उन्हें ऑक्सीकरण तथा जब किसी पदार्थ में से विद्युतऋणी तत्व निकलता है तो उन्हें अपचयन अभिक्रियाएँ कहते हैं ।
उदाहरण- ऑक्सीकरण
Ca + Cl2 → CaCl2
यहाँ कैल्सियम (Ca) का अधिक विद्युतऋणी तत्व क्लोरीन (Cl2) के साथ संयोग हो रहा है अतः यह एक ऑक्सीकरण अभिक्रिया है।
अपचयन-
2FeCl3 + H2 → 2FeCl2 + 2HCl
इस अभिक्रिया में FeCl3 में से ऋण विद्युत तत्व Cl के निकलने के कारण इसका अपचयन हो रहा है।
सारांश के रूप में ऑक्सीकरण वे अभिक्रियाएँ होती हैं जिनमें किसी पदार्थ के साथ ऑक्सीजन या किसी अन्य ऋणविद्युती तत्व का योग होता है। अथवा हाइड्रोजन या किसी अन्य धनविद्युती तत्व का निष्कासन होता है।
इसी प्रकार अपचयन वे अभिक्रियाएँ हैं जिनमें किसी पदार्थ के साथ हाइड्रोजन या किसी अन्य धनविद्युती तत्व का योग होता है अथवा ऑक्सीजन या किसी अन्य ऋणविद्युती तत्व का निष्कासन होता है।
आजकल ऑक्सीकरण तथा अपचयन की परिभाषा इलेक्ट्रॉन के आदान-प्रदान के आधार पर दी गई है। - इलेक्ट्रॉन के आदान-प्रदान के आधार पर ऑक्सीकरण-वे अभिक्रियाएँ जिनमें परमाणु, आयन या अणु इलेक्ट्रॉन त्यागता है, उन्हें ऑक्सीकरण अभिक्रियाएँ कहते हैं।
Na → Na+ + e–
Fe2+ → Fe3+ + e–
2Cl– → Cl2 + 2e
अतः ऑक्सीकरण की क्रिया में उदासीन परमाणु धनायन बनाता है या धनायन पर आवेश बढ़ता है या ऋणायन पर आवेश में कमी होती है।
अपचयन-वे अभिक्रियाएँ जिनमें परमाणु, आयन या अणु इलेक्ट्रॉन (e–) ग्रहण करता है, अपचयन कहलाती है।
Cl+e– → Cl–
MnO4-1 + e– परमैंग्नेट आयन → MnO4-2 मैंग्नेट आयन
Mg+2+2e– → Mg
अतः अपचयन अभिक्रयाओं में उदासीन परमाणु से ऋणायन बनता है या ऋणायन पर आवेश बढ़ता है या धनायन पर आवेश में कमी होती है।
उपापचयी अभिक्रिया-

उपरोक्त अभिक्रिया में Zn का ZnSO4 में ऑक्सीकरण (Zn → Zn+2 + 2e–) तथा कॉपर सल्फेट का Cu में अपचयन (Cu+2 + 2e– → Cu) हो रहा है।
प्रश्न 38. उत्प्रेरक की विशेषताएँ तथा उत्प्रेरक के प्रकारों के बारे में आप क्या जानते हैं?
उत्तर-
उत्प्रेरक-वे पदार्थ जो रासायनिक अभिक्रिया के वेग को परिवर्तित कर देते हैं किन्तु स्वयं अपरिवर्तित रहते हैं, उत्प्रेरक कहलाते हैं।
उत्प्रेरक की विशेषताएँ अथवा गुण निम्न प्रकार हैं
- उत्प्रेरक केवल रासायनिक अभिक्रिया के वेग में परिवर्तन के लिए उत्तरदायी होते हैं लेकिन उनके स्वयं के रासायनिक संघटन तथा मात्रा में कोई परिवर्तन नहीं होता है।
- अभिक्रिया मिश्रण में उत्प्रेरक की सूक्ष्म मात्रा ही आवश्यक होती है।
- प्रत्येक अभिक्रिया के लिये एक विशिष्ट उत्प्रेरक आवश्यक होता है अतः एक ही उत्प्रेरक सभी अभिक्रियाओं को उत्प्रेरित नहीं कर सकता।
- उत्प्रेरक अभिक्रिया को प्रारम्भ नहीं करता है केवल उसके वेग को बढ़ाता है।
- उत्क्रमणीय अभिक्रियाओं में उत्प्रेरक अग्र तथा प्रतीप दोनों अभिक्रियाओं के वेग को समान रूप से प्रभावित करता है।
- उत्प्रेरक एक निश्चित ताप पर ही अत्यधिक क्रियाशील होते हैं तथा ताप में परिवर्तन से इनकी क्रियाशीलता प्रभावित होती है।
उत्प्रेरकों के प्रकार-उत्प्रेरकों को भौतिक अवस्था तथा क्रिया के आधार पर निम्न प्रकार वर्गीकृत किया जाता है।
- भौतिक अवस्था के आधार पर
(a) समांगी उत्प्रेरक- जब किसी रासायनिक अभिक्रिया में उत्प्रेरक, अभिकारक एवं उत्पाद तीनों समान भौतिक अवस्था में होते हैं तो इस स्थिति में उत्प्रेरक को समांगी उत्प्रेरक तथा इस क्रिया को समांगी उत्प्रेरण कहते हैं। उदाहरण
2SO2(g) + O2(g) सल्फर डाईऑक्साइड →NO(g)→ 2SO3(g) सल्फरट्राईऑक्साइड
(b) विषमांगी उत्प्रेरक- जब रासायनिक अभिक्रियाओं में अभिकारक एवं उत्प्रेरक की भौतिक अवस्था भिन्न-भिन्न होती है तो इस स्थिति में उत्प्रेरक को विषमांगी उत्प्रेरक तथा इस क्रिया को विषमांगी उत्प्रेरण कहते हैं। उदाहरण
N2(g) + 3H2(g) →Fe(S)→ 2NH3(g) - क्रिया के आधार पर
(a) धनात्मक उत्प्रेरक- वे उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को बढ़ाते हैं, उन्हें धनात्मक उत्प्रेरक कहते हैं। उदाहरण
2KClO3 →MnO2→ 2KCl + 3O2
(b) ऋणात्मक उत्प्रेरक- वे उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को कम करते हैं, उन्हें ऋणात्मक उत्प्रेरक कहते हैं।
उदाहरण-ग्लिसरॉल की उपस्थिति में H2O2 के अपघटन की दर कम हो जाती है। अतः हाइड्रोजन परॉक्साइड को संग्रहित करने के लिए इसमें सूक्ष्म मात्रा में ग्लिसरॉल मिलाते हैं।
2H2O2 →ग्लिसरॉल → 2H2O + O2
(c) स्वतः उत्प्रेरक- जब किसी रासायनिक अभिक्रिया में बना उत्पाद ही उत्प्रेरक का कार्य करता है, तो इसे स्वतः उत्प्रेरक कहते हैं। उदाहरण
CH3COOC2H5 + H2O ⇔ CH3COOH + C2H5OH
यहाँ प्रारम्भ में अभिक्रिया का वेग कम होता है परन्तु एसीटिक अम्ल (CH3COOH) के कुछ मात्रा में बनने के पश्चात् अभिक्रिया का वेग बढ़ जाता है। अतः इस अभिक्रिया में एसीटिक अम्ल स्वतः उत्प्रेरक है।
(d) जैव उत्प्रेरक- वे पदार्थ जो जैव रासायनिक अभिक्रियाओं के वेग को बढ़ाते हैं, उन्हें जैव उत्प्रेरक (एन्जाइम) कहते हैं।
उदाहरण- माल्टोज →माल्टेज→ ग्लूकोज
प्रश्न 39. रासायनिक समीकरण को लिखने के चरण व इसकी विशेषताएँ लिखें।
उत्तर-
रासायनिक समीकरण-जब किसी रासायनिक अभिक्रिया में पदार्थों को अणुसूत्रों एवं प्रतीकों द्वारा प्रदर्शित किया जाता है तो उसे रासायनिक समीकरण कहते हैं। जैसे कार्बन को ऑक्सीजन की उपस्थिति में गर्म करने पर कार्बन डाईऑक्साइड गैस बनती है।
C + O2 → CO2
रासायनिक समीकरण को लिखने के चरण
- रासायनिक अभिक्रिया को लिखने के लिए समीकरण में सर्वप्रथम क्रियाकारकों को बायीं ओर लिखकर तीर का निशान (→) लगाया जाता है, तत्पश्चात् दायीं ओर उत्पादों को लिखा जाता है।
- क्रियाकारकों और उत्पादों की संख्या एक से अधिक होने पर उनके बीच धन का चिन्ह (+) लगाया जाता है। जैसे
C + O2 → CO2 - अभिकारकों तथा उत्पादों की भौतिक अवस्था को बताने के लिए उनके साथ कोष्ठक में ठोस के लिए (s), द्रव के लिए (l) तथा गैस के लिए (g) लिख देते हैं।
C(s) + O2(g) → CO2(g) - अभिकारक तथा उत्पाद जब जलीय विलयन के रूप में होते हैं तो उसके लिए (aq) लिखते हैं।
CaO(s) + H2O(l) → Ca(OH)2(aq). - अभिक्रिया उत्क्रमणीय होने अर्थात् दोनों दिशाओं में होने पर तीर का निशान ⇔ इस प्रकार लगाया जाता है।
- अभिक्रिया सम्पन्न होने के लिये आवश्यक ताप तथा दाब को तीर के निशान के ऊपर लिखते हैं।

- ऊष्माक्षेपी तथा ऊष्माशोषी अभिक्रिया के लिए उत्पाद के साथ क्रमशः धनचिन्ह (+) तथा ऋण चिन्ह (-) लगाकर ऊष्मा की मात्रा को भी लिखा जाता है। ऊष्मा को चिन्ह Δ से भी लिखा जाता है।
N2 + 3H2 → 2NH3 + 10.5 kcal/mole
N2 + 2O2 → 2NO2 – 21.6 kcal/mole - अभिक्रिया में प्रयुक्त उत्प्रेरक को तीर के निशान के ऊपर लिखा जाता है।

रासायनिक समीकरण की विशेषताएँ-रासायनिक समीकरण के द्वारा अभिक्रिया के बारे में एक संक्षिप्त जानकारी मिल जाती है। इसकी विशेषताएँ निम्नलिखित हैं
- क्रियाकारक और उत्पाद के बारे में अणुओं की संख्या, द्रव्यमान आदि की सम्पूर्ण जानकारी मिलती है।
- पदार्थों की भौतिक अवस्था के बारे में जानकारी प्राप्त होती है।
- रासायनिक अभिक्रिया के लिये आवश्यक परिस्थितियों जैसे ताप, दाब तथा उत्प्रेरक आदि के बारे में ज्ञात हो जाता है।
- अभिक्रिया ऊष्माक्षेपी है या ऊष्माशोषी यह भी स्पष्ट हो जाता है।
- रासायनिक समीकरण से अभिक्रिया की उत्क्रमणीयता की जानकारी भी हो जाती है।
प्रश्न 40. निम्नलिखित में अंतर बताइए
(a) उत्क्रमणीय-अनुत्क्रमणीय अभिक्रिया
(b) उत्प्रेरक वर्धक-उत्प्रेरक विष
(c) समांगी-विषमांगी उत्प्रेरण
(d) ऑक्सीकरण-अपचयन।
उत्तर-
(a) उत्क्रमणीय-अनुत्क्रमणीय अभिक्रिया

(b) उत्प्रेरक वर्धक-उत्प्रेरक विषउत्प्रेरक वर्धक ।
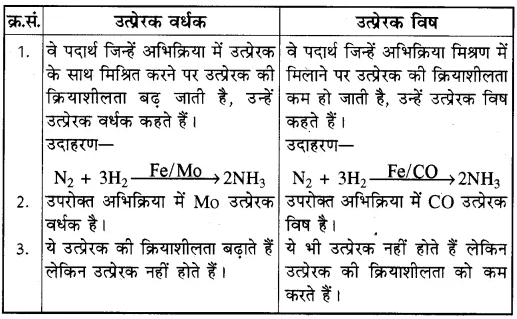
(c) समांगी-विषमांगी उत्प्रेरण
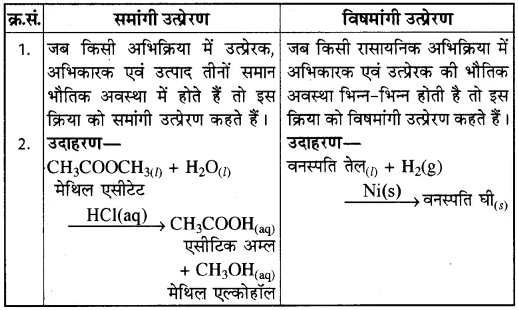
(d) ऑक्सीकरण-अपचयनक्र.सं. ऑक्सीकरण
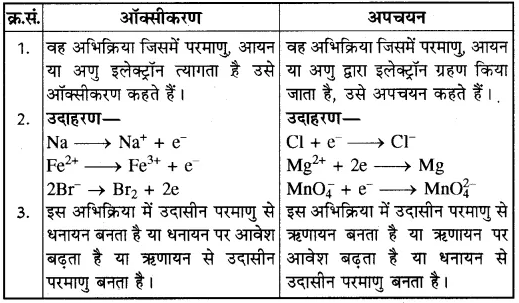
(अन्य महत्त्वपूर्ण प्रश्नोत्तर)
वस्तुनिष्ठ प्रश्न
1. जब पोटेशियम धातु की जल से क्रिया करवाते हैं तो इसका
(अ) ऑक्सीकरण होता है
(ब) अपचयन होता है।
(स) अप्रभावित रहता है।
(द) जल अपघटन होता है।
2. ऊष्माशोषी अभिक्रिया है
(अ) CaO का जल में घुलना
(ब) NH4Cl का जलीय विलयन बनाना
(स) NaOH का जलीय विलयन बनाना
(द) उपरोक्त सभी
3. H2 +Cl2 → 2HCl में
(अ) H2 का अपचयन हो रहा है
(ब) H2 का ऑक्सीकरण हो रहा है।
(स) Cl2 का ऑक्सीकरण हो रहा है।
(द) उपरोक्त सभी
4. नीचे दी गयी अभिक्रिया के संबंध में कौनसा कथन असत्य है?
2PbO(s) + C(s) → 2Pb(s) + CO2(g)
(i) सीसा अपचयित हो रहा है।
(ii) कार्बन डाइऑक्साइड ऑक्सीकृत हो रही है।
(iii) कार्बन ऑक्सीकृत हो रहा है।
(iv) लेड ऑक्साइड अपचयित हो रहा है।
(अ) (i) एवं (ii)
(ब) (i) एवं (iii)
(स) (i), (ii) एवं (iii)
(द) उपरोक्त सभी
5. अभिक्रिया Fe2O3 + 2Al → Al2O3 + 2Fe किस प्रकार की है?
(अ) संयोजन अभिक्रिया
(ब) द्विविस्थापन अभिक्रिया
(स) वियोजन अभिक्रिया
(द) विस्थापन अभिक्रिया
6. लौह-चूर्ण पर तनु हाइड्रोक्लोरिक अम्ल डालने से क्या होता है?
(अ) हाइड्रोजन गैस एवं आयरन क्लोराइड बनता है।
(ब) क्लोरीन गैस एवं आयरन हाइड्रॉक्साइड बनता है।
(स) कोई अभिक्रिया नहीं होती है।
(द) आयरन लवण एवं जल बनता है।
7. अभिक्रिया-वनस्पति तेल + H2 →Ni→ वनस्पति घी, में उत्प्रेरक वर्धक है
(अ) Fe
(ब) Mo
(स) Cu
(द) Co
8. अभिक्रिया Zn + CuSO4 → ZnSO4 + Cu में किस पदार्थ का ऑक्सीकरण हो रहा है?
(अ) CuSO4
(ब) Zn
(स) ZnSO4
(द) उपरोक्त में से कोई नहीं
9. NH4Cl के विलयन की pH होगी
(अ) 7
(ब) 7 से कम
(स) 7 से अधिक
(द) कुछ नहीं कहा जा सकता।
10. निम्न में से कौनसा भौतिक परिवर्तन नहीं है?
(अ) लोहे का चुम्बक बनना
(ब) कार्बन के जलने पर CO2 का बनना
(स) नौसादर (NH4Cl) का उर्ध्वपातन
(द) शक्कर का जल में विलेय होना ।
उत्तरमाला- 1. (अ) 2. (ब) 3. (ब) 4. (अ) 5. (द) 6. (अ) 7. (स) 8. (ब) 9. (ब) 10. (ब)
अतिलघूत्तरात्मक प्रश्न
प्रश्न 1. निम्नलिखित रासायनिक समीकरण को संतुलित रूप में लिखिए
Pb(NO3)2(s) →ऊष्मा→ PbO(s) + NO2(g) + O2(g)
उत्तर-
Pb(NO3)2(S) →ऊष्मा→ PbO(s) + 2NO2(g) + O2(g)
प्रश्न 2. चिप्स की थैली में कौनसी गैस भरी जाती है ताकि उनका ऑक्सीकरण न हो सके?
उत्तर-
नाइट्रोजन गैस
प्रश्न 3. अपघटनीय अभिक्रिया के लिए उत्तरदायी कारक बताइए।
उत्तर-
ताप, विद्युत तथा प्रकाश।
प्रश्न 4. पोटेशियम क्लोरेट को गर्म करने पर कौनसी गैस निकलती है?
उत्तर-
पोटेशियम क्लोरेट को गर्म करने पर ऑक्सीजन गैस निकलती है।
2KClO3 (s) →गर्भ→2KCl(s) + 3O2(g)↑
प्रश्न 5. Pb(s) + CuCl2(aq) → PbCl2(aq) + Cu(s) किस प्रकार की अभिक्रिया है?
उत्तर-
विस्थापन एवं रेडॉक्स (उपापचयी) अभिक्रिया।
प्रश्न 6. मैग्नीशियम रिबन को वायु में जलाने पर क्या बनता है?
उत्तर-
श्वेत मैग्नीशियम ऑक्साइड।
प्रश्न 7. मैग्नीशियम रिबन को वायु में जलाने पर मैग्नीशियम ऑक्सीकृत होता है या अपचयित? (2Mg + O2 →2 MgO)
उत्तर-
मैग्नीशियम ऑक्सीकृत होता है।
प्रश्न 8. CH4(g) + O2 → CO2(g) + H2O का संतुलित रासायनिक समीकरण क्या होगा?
उत्तर-
CH4(g) + 2O2(g) → CO2(g) + 2H2O (l)
प्रश्न 9. N2 तथा H2 की अभिक्रिया का संतुलित रासायनिक समीकरण लिखिए।
उत्तर-
N2(g) + 3H2(g) → 2NH3(g)
प्रश्न 10. कैल्सियम ऑक्साइड को जल में घोलने पर ऊष्मा में क्या परिवर्तन होता है?
उत्तर-
कैल्सियम ऑक्साइड (CaO) को जल में घोलने पर ऊष्मा उत्सर्जित होती है।
प्रश्न 11. कॉपर से अधिक सक्रिय तीन धातुओं के नाम लिखिए।
उत्तर-
आयरन (Fe), जिंक (Zn) तथा मैग्नीशियम (Mg)
प्रश्न 12. अभिक्रिया H2S + Br2 → 2HBr + S में किस पदार्थ का अपचयन हो रहा है?
उत्तर-
Br2 (ब्रोमीन) का।
प्रश्न 13. संगमरमर (Marble) का रासायनिक सूत्र क्या है?
उत्तर-
CaCO3 (कैल्सियम कार्बोनेट)।
प्रश्न 14. Zn, Pb तथा Cu की क्रियाशीलता का क्रम लिखिए।
उत्तर-
Zn > Pb > Cu
प्रश्न 15. एन्जाइमों का संघटन तथा विशेषता बताइए।
उत्तर-
एन्जाइम जटिल नाइट्रोजन युक्त कार्बनिक यौगिक होते हैं जो कि भिन्न-भिन्न जैव रासायनिक क्रियाओं के लिए विशिष्ट होते हैं।
प्रश्न 16. उत्क्रमणीय अभिक्रियाओं में कौनसी दो अभिक्रियाएँ साथ-साथ चलती हैं ?
उत्तर-
उत्क्रमणीय अभिक्रियाओं में अग्र अभिक्रिया तथा प्रतीप अभिक्रिया साथ-साथ चलती हैं।
प्रश्न 17. एक जैव रासायनिक उत्क्रमणीय अभिक्रिया का उदाहरण बताइए।
उत्तर-
रक्त में हीमोग्लोबिन द्वारा कार्बन डाईऑक्साइड तथा ऑक्सीजन का वहन एक जैव रासायनिक उत्क्रमणीय अभिक्रिया है।
प्रश्न 18. उत्प्रेरक वर्धक का एक उदाहरण दीजिए।
उत्तर-
अभिक्रिया-वनस्पति तेल + H2 →Ni/Cu→ वनस्पति घी, में Ni उत्प्रेरक तथा Cu उत्प्रेरक वर्धक है।
प्रश्न 19. सक्रियता श्रेणी किसे कहते हैं ?
उत्तर-
तत्वों को उनकी क्रियाशीलता के घटते क्रम में रखने पर प्राप्त श्रेणी को सक्रियता श्रेणी कहते हैं।
प्रश्न 20. भौतिक परिवर्तन किसे कहते हैं ?
उत्तर-
वह परिवर्तन जिसमें पदार्थ के भौतिक गुण तथा अवस्था में परिवर्तन होता है लेकिन रासायनिक गुणों में कोई परिवर्तन नहीं होता है, उसे भौतिक परिवर्तन कहते हैं।
प्रश्न 21. दूध से दही बनना तथा तैयार सब्जी का कुछ घण्टों बाद खराब होना किस प्रकार के परिवर्तन हैं ?
उत्तर-
रासायनिक परिवर्तन।
प्रश्न 22. कॉपर सल्फेट नीले रंग के विलयन में जिंक के टुकड़े डालने पर नीला रंग विलुप्त हो जाता है, क्यों ?
उत्तर-
ZnSO4 तथा Cu बनने के कारण।
प्रश्न 23. ऑक्सीकरण तथा अपचयन की इलेक्ट्रॉनिक परिभाषा लिखिए।
उत्तर-
वह अभिक्रिया जिसमें कोई स्पीशीज (तत्व, परमाणु, आयन या अणु) इलेक्ट्रॉन का त्याग करता है, उसे ऑक्सीकरण तथा इन स्पीशीज द्वारा इलेक्ट्रॉन ग्रहण किया जाता है तो उसे अपचयन कहते हैं।
प्रश्न 24. अपचायक किसे कहते हैं ?
उत्तर-
वे पदार्थ जिनका ऑक्सीकरण होता है तथा इलेक्ट्रॉन का त्याग करते हैं, उन्हें अपचायक कहते हैं।
प्रश्न 25. ऑक्सीकारक किसे कहते हैं ?
उत्तर-
वे पदार्थ जिनका अपचयन होता है तथा इलेक्ट्रॉन ग्रहण करते हैं, उन्हें ऑक्सीकारक कहते हैं।
सुमेलन सम्बन्धी प्रश्न
प्रश्न 1. निम्नलिखित को सुमेलित कीजिए
(i) बर्फ का पिघलना (A) एन्जाइम
(ii) उपापचयी (रेडॉक्स) अभिक्रिया (B) भौतिक परिवर्तन
(iii) जैव उत्प्रेरक (C) CuO(s) + H2(g) → Cu(s) + H2O(l)
उत्तर-
(i) (B)
(ii) (C)
(iii) (A)
प्रश्न 2. निम्नलिखित को सुमेलित कीजिए
(i) संयुग्मन अभिक्रिया (A) इलेक्ट्रॉन दाता पदार्थ N;
(ii) अपचायक (B) वनस्पति तेल(l) + H2(g) →Ni(s)→ वनस्पति घी(s)
(iii) विषमांगी उत्प्रेरण (C) 2Mg(s) + O2(g) → 2MgO(s)
उत्तर-
(i) (C)
(ii) (A)
(iii) (B)
लघूत्तरात्मक प्रश्न
प्रश्न 1. निम्नलिखित में कोई एक अन्तर लिखिए
(अ) धनात्मक एवं ऋणात्मक उत्प्रेरक
(ब) ऊष्मीय-अपघटन एवं विद्युत-अपघटन
(स) संकलन एवं विस्थापन अभिक्रिया (माध्य. शिक्षा बोर्ड, 2018)
उत्तर-
(अ) वे उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को बढ़ाते हैं, उन्हें धनात्मक उत्प्रेरक कहते हैं जबकि ऋणात्मक उत्प्रेरक रासायनिक अभिक्रिया के वेग को कम करते हैं।
धनात्मक उत्प्रेरक- 2SO2 + O2 →NO→ 2SO3
ऋणात्मक उत्प्रेरक- 2H2O2 →ग्लिसरील→ 2H2O + O2
(ब) ऊष्मीय अपघटन में यौगिक को ऊष्मा देने पर वह छोटे अणुओं में टूट जाता है जबकि विद्युत अपघटन में किसी यौगिक की गलित या द्रव अवस्था में विद्युत धारा प्रवाहित करने पर वह अपघटित होकर कैथोड तथा एनोड पर भिन्न-भिन्न उत्पाद बनाता है।
(स) संकलन (योगात्मक या संयुग्मन) अभिक्रिया में दो या दो से अधिक अभिकारक आपस में संयोग करके एक ही उत्पाद बनाते हैं जबकि विस्थापन अभिक्रिया में एक अभिकारक में उपस्थित परमाणु या समूह दूसरे अभिकारक के परमाणु या समूह द्वारा विस्थापित होता है।
प्रश्न 2. संयुग्मन, विस्थापन एवं अपघटनीय अभिक्रियाओं को दर्शाने वाली एक-एक रासायनिक समीकरण लिखिए। (माध्य. शिक्षा बोर्ड, मॉडल पेपर, 2017-18 )
उत्तर-
- संयुग्मन अभिक्रिया
C(s) + O2(g)→CO2(g) - विस्थापन अभिक्रिया
CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s) - अपघटनीय अभिक्रिया
2H2O(l) →विद्युत धारा→ 2H2(g) + O2(g)
प्रश्न 3. रेडॉक्स अभिक्रियाएँ किसे कहते हैं? अभिक्रिया ZnO + C → Zn + CO में किस पदार्थ का ऑक्सीकरण एवं किसका अपचयन हो रहा है?
उत्तर-
रेडॉक्स अभिक्रिया-ऐसी रासायनिक अभिक्रिया, जिसमें एक अभिकारक ऑक्सीकृत तथा दूसरा अभिकारक अपचयित होता है अर्थात् जिसमें ऑक्सीकरण तथा अपचयन अभिक्रियाएँ एक साथ होती हैं, उसे रेडॉक्स अभिक्रिया कहते हैं।
उपरोक्त अभिक्रिया में ZnO का अपचयन तथा C का ऑक्सीकरण हो रहा है।
प्रश्न 4. अभिक्रिया CuO + H2 → Cu + H2O में किस पदार्थ का ऑक्सीकरण एवं किस पदार्थ का अपचयन हो रहा है? इस प्रकार की अभिक्रिया का एक अन्य उदाहरण दीजिए।
उत्तर-
अभिक्रिया CuO + H2 → Cu + H2O में H2 का ऑक्सीकरण तथा CuO का अपचयन हो रहा है।”
अन्य उदाहरण- 4Na + O2 → 2 Na2O
प्रश्न 5. (अ) रेडॉक्स अभिक्रिया का एक उदाहरण दीजिए।
(ब) निम्न अभिक्रियाओं में A को पहचानिए
(i) Zn + CuSO4 → A + Cu
(ii) Na2SO4 + BaCl2 → A + 2NaCl
उत्तर-
(अ) CuO + H2 →Δ→ Cu+ H2O
(ब) (i) Zn + CuSO4 → ZnSO4 + Cu (जिंक सल्फेट)
(ii) Na2SO4 + BaCl2 → BaSO4 + 2NaCl (बेरियम सल्फेट)
अतः अभिक्रिया (i) में (A) ZnSO4 है तथा (ii) में (A) BaSO4 है।
प्रश्न 6. निम्न समीकरणों में X, Y व Z को पहचानिए
(i) Cu + CO2 →नमी→ हरा पदार्थ (X)
(ii) Ag + Y →हेवा→ काला पदार्थ (Ag2S)
(iii) FeSO4 →ऊष्मा→ Fe2O3 + SO3 + Z
उत्तर-
X = CuCO3, Y = H2S, Z = SO2
प्रश्न 7. निम्नलिखित अभिक्रियाओं के उत्पाद लिखिए
(i) CuSO4 (aq) + Fe (S) →
(ii) Zn (s) + H2SO4 (l) →
(iii) 4Na (s) + O2 (g) →
उत्तर-
(i) CuSO4 (aq) + Fe (s) → FeSO4 (aq) + Cu (s)
(ii) Zn (s) + H2SO4 (l) → ZnSO4 (aq) + H2 (g)
(iii) 4Na (s) + O2 (g) → 2Na2O (s)
RBSE BSER CLASS X SCIENCE LESSON 6 CHEMICAL REACTION & CATALYST
प्रश्न 8. निम्न अभिक्रियाओं के लिए संतुलित रासायनिक समीकरण लिखिए
(अ) कैल्सियम हाइड्रोक्साइड + कार्बन डाइऑक्साइड → कैल्सियम कार्बोनेट + जल
(ब) जिंक + सिल्वर नाइट्रेट → जिंक नाइट्रेट + सिल्वर
(स) ऐलुमिनियम + कॉपर क्लोराइड → ऐलुमिनियम क्लोराइड + कॉपर
(द) बेरियम क्लोराइड + पोटैशियम सल्फेट → बेरियम सल्फेट + पोटैशियम क्लोराइड
उत्तर-
संतुलित रासायनिक समीकरण
(अ) Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)
(ब) Zn(s) + 2AgNO3 (aq) → Zn(NO3)2(aq) + 2Ag(s)
(स) 2Al(s) + 3CuCl2(aq) → 2AlCl3(aq) + 3Cu(S)
(द) BaCl2(aq) + K2SO4(aq) → BaSO4(s) + 2KCl(aq)
प्रश्न 9. निम्नलिखित अभिक्रियाओं के लिए उनकी अवस्था के संकेतों के साथ संतुलित रासायनिक समीकरण लिखिए
(i) जेल में बेरियम क्लोराइड तथा सोडियम सल्फेट के विलयन अभिक्रिया करके सोडियम क्लोराइड का विलयन तथा अघुलनशील बेरियम सल्फेट का अवक्षेप बनाते हैं।
(ii) सोडियम हाइड्रोक्साइड का विलयन (जल में ) हाइड्रोक्लोरिक अम्ल के विलयन (जल में) से अभिक्रिया करके सोडियम क्लोराइड का विलयन तथा जल बनाते हैं।
उत्तर-
(i) BaCl2(aq) + Na2SO4(aq) → 2NaCl(aq) + BaSO4(s)
(ii) NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
प्रश्न 10. किसी पदार्थ ‘x’ के विलयन का उपयोग सफेदी करने के लिए होता है।
(i) पदार्थ ‘X’ का नाम तथा रासायनिक सूत्र लिखिए।
(ii) पदार्थ ‘X’ की जल के साथ अभिक्रिया लिखिए।
उत्तर-
(i) पदार्थ ‘X’ कैल्सियम ऑक्साइड है। जिसका उपयोग सफेदी करने के लिए होता है। इसे चूना या बिना बुझा हुआ चूना भी कहते हैं। इसका रासायनिक सूत्र CaO है।
(ii) CaO(s) + H2O(l)(बिना बुझा हुआ चूना) → Ca(OH)2(aq) (बुझा हुआ चूना) (कैल्सियम हाइड्रॉक्साइड)
प्रश्न 11. जब लोहे की कील को कॉपर सल्फेट के विलयन में डुबोया जाता है तो विलयन का रंग क्यों बदल जाता है?
उत्तर-
जब लोहे की कील को कॉपर सल्फेट के विलयन में डुबोया जाता है। तो निम्नलिखित अभिक्रिया होती है। इसमें लोहा (आयरन), कॉपर सल्फेट के विलयन से कॉपर को विस्थापित कर देता है।
Fe(s) (आयरन) + CuSO4 (aq) (कॉपर सल्फेट) → FeSO4 (aq) (आयरन सल्फेट) + Cu(s) (कॉपर)
इस अभिक्रिया में लोहे की कील का रंग भूरा हो जाता है तथा कॉपर सल्फेट के विलयन का नीला रंग धीरे-धीरे गायब होने लगता है।
प्रश्न 12. (a) किसी रासायनिक समीकरण की सीमाएँ बताइए।
(b) उत्प्रेरण किसे कहते हैं? उदाहरण भी दीजिए।
उत्तर-
(a) बहुत सी विशेषताओं के बाद भी रासायनिक समीकरण की निम्न सीमाएँ हैं
- यह अभिक्रिया की पूर्णता की जानकारी नहीं देता है।
- इससे क्रियाकारक तथा उत्पाद की सान्द्रता के बारे में स्पष्ट नहीं होता है।
(b) उत्प्रेरण-वे पदार्थ जो रासायनिक अभिक्रिया के वेग में परिवर्तन कर देते हैं, परन्तु स्वयं अपरिवर्तित रहते हैं, उन्हें उत्प्रेरक कहते हैं तथा इस क्रिया को उत्प्रेरण कहते हैं।
उदाहरण-
2KClO3 →MnO2→ 2KCl + 3O2
प्रश्न 13. प्रमुख तत्त्वों की सक्रियता श्रेणी लिखिए।
उत्तर-
प्रमुख तत्त्वों की सक्रियता श्रेणी
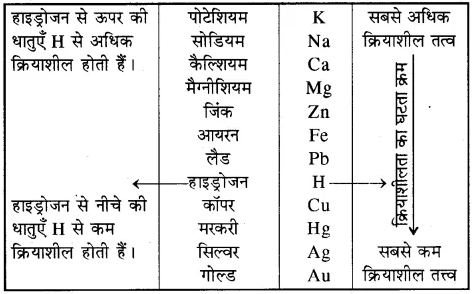
प्रश्न 14. रासायनिक समीकरण किसे कहते हैं? समझाइए।
उत्तर-
किसी रासायनिक अभिक्रिया में उपस्थित सभी अभिकारकों एवं उत्पादों को तथा प्रतीकों के रूप में उनकी भौतिक अवस्था को प्रदर्शित करने को रासायनिक समीकरण कहते हैं।
वाक्य के रूप में किसी रासायनिक अभिक्रिया का विवरण बहुत लम्बा हो जाता है अतः इसे संक्षिप्त रूप में लिखा जाता है। इसकी सबसे सरल विधि शब्द समीकरण होती है। जैसे-मैग्नीशियम की ऑक्सीजन से क्रिया होने पर मैग्नीशियम ऑक्साइड बनता है। अतः इसका शब्द समीकरण इस प्रकार होगा
मैग्नीशियम (अभिकारक) + ऑक्सीजन → मैग्नीशियम ऑक्साइड (उत्पाद)
इस अभिक्रिया में मैग्नीशियम तथा ऑक्सीजन ऐसे पदार्थ हैं जिनमें रासायनिक परिवर्तन होता है, इन्हें अभिकारक कहते हैं तथा एक नया पदार्थ मैग्नीशियम ऑक्साइड बनता है, इसे उत्पाद कहते हैं।
प्रश्न 15. संतुलित रासायनिक समीकरण क्या है? रासायनिक समीकरण को संतुलित करना क्यों आवश्यक है?
उत्तर-
संतुलित रासायनिक समीकरण-संतुलित रासायनिक समीकरण वह होता है, जिसके दोनों पक्षों (अभिकारक एवं उत्पाद) में प्रत्येक तत्व के परमाणुओं की संख्या बराबर होती है।
रासायनिक समीकरण को संतुलित करने का महत्त्व-द्रव्यमान संरक्षण नियम के अनुसार किसी भी रासायनिक अभिक्रिया में द्रव्य का न तो निर्माण होता है न ही विनाश अर्थात् किसी भी रासायनिक अभिक्रिया के उत्पाद तत्वों का कुल द्रव्यमान अभिकारक तत्वों के कुल द्रव्यमान के बराबर होता है। अतः रासायनिक अभिक्रिया के पहले एवं बाद में प्रत्येक तत्व के परमाणुओं की संख्या समान होती है। इसलिए कंकाली समीकरण को संतुलित करना आवश्यक है।
जैसे- Fe + H2O → Fe3O4 + 4H2 (कंकाली समीकरण)
3Fe + 4H2O → Fe3O4 + 4H2 (संतुलित समीकरण)
प्रश्न 16. अपचायक तथा ऑक्सीकारक क्या होते हैं? समझाइए।
उत्तर-
वे पदार्थ जिनका ऑक्सीकरण होता है तथा ये इलेक्ट्रॉन त्यागकर दूसरे पदार्थ को अपचयित करते हैं, उन्हें अपचायक कहते हैं। वे पदार्थ जिनका अपचयन होता है तथा इलेक्ट्रॉन ग्रहण कर दूसरे पदार्थ को ऑक्सीकृत करते हैं, उन्हें ऑक्सीकारक कहते हैं। अतः अपचायक इलेक्ट्रॉनदाता तथा ऑक्सीकारक इलेक्ट्रॉनग्राही होता है।
प्रश्न 17. क्या होता है जब? ( केवल रासायनिक समीकरण दीजिए)
(i) चूने के पानी में कार्बन डाइऑक्साइड गैस प्रवाहित की जाती है।
(ii) जिंक धातु की सोडियम हाइड्रॉक्साइड से क्रिया की जाती है।
(iii) बुझे हुए चूने के साथ क्लोरीन की क्रिया करवाई जाती है।
उत्तर-
(i) Ca(OH)2(aq) चूने का पानी। (कैल्सियम हाइड्रॉक्साइड) + CO2(g) → CaCO3(s) (कैल्सियम कार्बोनेट) + H2O(l)
(ii) Zn (जिंक) + 2NaOH (सोडियम हाइड्रॉक्साइड) → Na2ZnO2(सोडियम जिंकेट) + H2
(iii) Ca(OH)2 (बुझा हुआ चूना) कैल्सियम हाइड्रॉक्साइड + Cl2 → CaOCl2 (ब्लीचिंग पाउडर) + H2O
प्रश्न 18. ऊष्माक्षेपी एवं ऊष्माशोषी अभिक्रिया का क्या अर्थ है? उदाहरण सहित समझाइए।
उत्तर-
ऊष्माक्षेपी अभिक्रिया- वह अभिक्रिया, जिसमें उत्पाद के साथसाथ ऊर्जा/ऊष्मा भी उत्पन्न होती है, उसे ऊष्माक्षेपी अभिक्रिया कहते हैं।
उदाहरण-
(i) प्राकृतिक गैस का दहन
CH4 (g) + 2O2(g) → CO2(g) + 2H2O(g) + ऊर्जा
(ii) श्वसन भी एक ऊष्माक्षेपी अभिक्रिया है।
ऊष्माशोषी अभिक्रिया- वह अभिक्रिया, जिसमें ऊष्मा को अवशोषण होता है, उसे ऊष्माशोषी अभिक्रिया कहते हैं।
उदाहरण-
(i) N2(g) + O2(g) → 2NO(g)
(ii) शर्करा का जल में विलयन बनाना।
RBSE BSER CLASS X SCIENCE LESSON 6 CHEMICAL REACTION & CATALYST
प्रश्न 19. वियोजन (अपघटनीय) अभिक्रिया को संयोजन (संयुग्मन) अभिक्रिया के विपरीत माना जाता है, क्यों? उदाहरण सहित समझाइए।
उत्तर-
वियोजन अभिक्रिया संयोजन अभिक्रिया की विपरीत होती है क्योंकि वियोजन अभिक्रिया में एक अभिकारक टूटकर छोटे-छोटे एक से अधिक उत्पाद बनाता है जबकि संयोजन अभिक्रिया में दो या दो से अधिक पदार्थ (तत्व या यौगिक) मिलकर एक नया पदार्थ बनाते हैं।
संयोजन अभिक्रिया-
उदाहरण-
2H2(g) + O2(g) → 2H2O(l)
वियोजन अभिक्रिया-
2FeSO4(s) फेरस सल्फेट (हरा रंग) → Fe2O3(s) फेरिक ऑक्साइड + SO2(g) + SO3(g)
प्रश्न 20. ऑक्सीजन के संयोग तथा विलोपन के आधार पर निम्न पदों की व्याख्या कीजिए। प्रत्येक के लिए दो उदाहरण भी दीजिए
(a) ऑक्सीकरण
(b) अपचयन।
उत्तर-
(a) ऑक्सीकरण-
वह अभिक्रिया, जिसमें किसी पदार्थ के साथ
ऑक्सीजन का संयोग होता है अर्थात् ऑक्सीजन की वृद्धि होती है, उसे ऑक्सीकरण कहते हैं।
ऑक्सीकरण के उदाहरण
- 2Cu(s) + O2(g) → 2CuO(s) कॉपर ऑक्साइड (काला रंग)
- C(s) + O2(g) → CO2(g)
(b) अपचयन-
वह अभिक्रिया, जिसमें किसी पदार्थ में से ऑक्सीजन निकलती है अर्थात् ऑक्सीजन की कमी होती है, अपचयन अभिक्रिया कहलाती है।
अपचयन के उदाहरण
- CuO(s) + H2(g) →ताप→ Cu(s) भूरा रंग + H2O(l)
- ZnO(s) + C(s) → Zn (S) + CO (g)
प्रश्न 21. विस्थापन एवं द्विविस्थापन अभिक्रियाओं में क्या अंतर है? इन अभिक्रियाओं के उदाहरण भी दीजिए।
उत्तर-
विस्थापन एवं द्विविस्थापन अभिक्रियाओं में अन्तर—
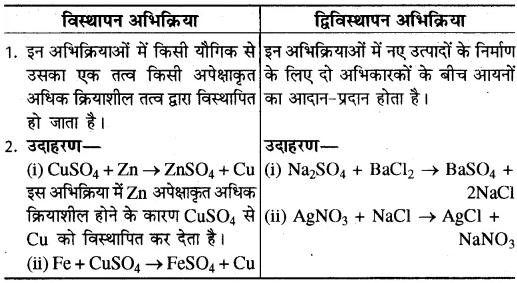
प्रश्न 22. उत्क्रमणीय अभिक्रिया की व्याख्या कीजिए।
उत्तर-
अभिक्रिया–A + B ⇔ C + D (उत्क्रमणीय)
उत्क्रमणीय अभिक्रिया एक साथ दोनों दिशाओं (अग्र व प्रतीप) में होती है। सर्वप्रथम अभिकारकों (A+ B) से उत्पादों (C+ D) का निर्माण होता है। उपयुक्त मात्रा में उत्पाद बनते ही प्रतीप अभिक्रिया प्रारम्भ होकर पुनः अभिकारकों का निर्माण होने लगता है। उत्क्रमणीय अभिक्रिया कभी भी पूर्ण नहीं होती है तथा हर समय अभिक्रिया मिश्रण में अभिकारक एवं उत्पाद दोनों उपस्थित होते हैं । सामान्यतः उत्क्रमणीय अभिक्रिया बन्द पात्र में होती है।
उदाहरण
(i) N2 + 3H2 ⇔ 2NH3
(ii) H2O + H2CO3 ⇔ H3O+ + HCO–3
प्रश्न 23. भौतिक परिवर्तन की प्रमुख विशेषताएँ अथवा गुण बताइए।
उत्तर-
भौतिक परिवर्तन के प्रमुख गुण निम्नलिखित हैं
- भौतिक परिवर्तन में पदार्थ के केवल भौतिक गुणों जैसे अवस्था, रंग, गंध आदि में परिवर्तन होता है।
- इसमें परिवर्तन का कारण हटाने पर पुनः प्रारम्भिक पदार्थ प्राप्त हो जाता है।
- यह परिवर्तन अस्थायी होता है।
- इस परिवर्तन में नए पदार्थ का निर्माण नहीं होता है।
प्रश्न 24. रासायनिक अभिक्रिया से क्या आशय है? उदाहरण सहित समझाइए।
उत्तर-
रासायनिक अभिक्रिया-वह अभिक्रिया जिसमें प्राप्त उत्पाद मूल पदार्थ से रासायनिक गुणों एवं संघटन में भिन्न होता है, उसे रासायनिक अभिक्रिया कहते हैं। रासायनिक अभिक्रिया में अभिकारकों से उत्पादों का निर्माण होता है परन्तु पदार्थ का कुल द्रव्यमान संरक्षित रहता है। रासायनिक अभिक्रिया को रासायनिक समीकरण से व्यक्त किया जाता है। उदाहरण
2 Mg(s) + O2 → 2MgO(s)
मैग्नीशियम के फीते को ऑक्सीजन में जलाने पर मैग्नीशियम ऑक्साइड का श्वेत रंग का चूर्ण प्राप्त होता है।
अन्य उदाहरण-
C(s) + O2(g) → CO2(g)
इस प्रकार रासायनिक अभिक्रियाओं में यौगिकों के परमाणुओं के मध्य उपस्थित बंध टूटते हैं तथा नये बंधों का निर्माण होता है।
प्रश्न 25. रासायनिक समीकरण को किस प्रकार संतुलित किया जाता है, समझाइए।
उत्तर-
रासायनिक समीकरण को अनुमान विधि द्वारा संतुलित किया जाता है। जिसमें अभिक्रिया को दोनों ओर, अणुओं की संख्या को घटाया या बढ़ाया जाता है।
रासायनिक समीकरण को संतुलित करने के लिए सर्वप्रथम ऑक्सीजन तथा हाइड्रोजन को छोड़कर अन्य परमाणुओं को संतुलित करते हैं। जैसे
C3H8 प्रोपेन + O2 → CO2 + H2O
C3H8 + O2 → 3CO2 + H2O
यहाँ C को संतुलित किया गया। अब हाइड्रोजन को संतुलित करते हैं तथा अन्त में ऑक्सीजन को संतुलित किया जाता है।
C3H8 + O2 → 3CO2 + 4H2O
C3H8 + 5O2 → 3CO2 + 4H2O
निबन्धात्मक प्रश्न
प्रश्न 1. अभिक्रियाओं के वेग के आधार पर रासायनिक अभिक्रियाओं के वर्गीकरण को समझाइए।
उत्तर-
वेग के आधार पर रासायनिक अभिक्रियाएँ दो प्रकार की होती हैं
(a) तीव्र अभिक्रिया
(b) मंद अभिक्रिया
(a) तीव्र अभिक्रिया- ये अभिक्रियाएँ अत्यन्त तेजी से सम्पन्न होती हैं। सामान्यतया ऐसी अभिक्रियाएँ आयनिक होती हैं जैसे-प्रबल अम्ल व प्रबल क्षार के मध्य अभिक्रिया 10-10 सेकण्ड में ही सम्पन्न हो जाती है।
NaOH प्रबल क्षार + HCl प्रबल अम्ल → NaCl + H2O (10-10sec)
AgNO3 + HCl → AgCl श्वेत अवक्षेप + HNO3
सिल्वर नाइट्रेट विलयन तथा हाइड्रोक्लोरिक अम्ल विलयन को मिलाते ही सिल्वर क्लोराइड (AgCl) का श्वेत अवक्षेप बन जाता है। पौधों में प्रकाश संश्लेषण अभिक्रिया भी बहुत तेज होती है तथा इस अभिक्रिया का अर्द्धआयु काले (tip) 10-12 सेकण्ड होता है।
(b) मंद अभिक्रिया- वे रासायनिक अभिक्रियाएँ जिनको पूर्ण होने में कई घंटे, दिन या वर्ष तक लग जाते हैं, उन्हें मंद रासायनिक अभिक्रिया कहते हैं। ये अभिक्रियाएँ बहुत धीमी गति से होती हैं, जैसे लोहे पर जंग लगने की क्रिया वर्षों तक चलती रहती है।
4Fe + 3O2 + 6H2O → 2Fe2O3.3H2O
अन्य उदाहरण-
2KClO3 →Δ→ 2KCl + O2
CH3COOH एसीटिक अम्ल + C2H5OH एथेनॉल → CH3COOC2H5 एथिल एसीटेट + H2O
RBSE BSER CLASS X SCIENCE LESSON 6 CHEMICAL REACTION & CATALYST
प्रश्न 2. सिद्ध कीजिए कि किसी अभिक्रिया में उत्पादों तथा अभिकारकों का द्रव्यमान हमेशा समान रहता है।
उत्तर-
अभिक्रिया-2Mg(s) + O2(g) →Δ→2MgO(s) में मैग्नीशियम के फीते को जलाने पर मैग्नीशियम ऑक्साइड का श्वेत चूर्ण बनता है। इस अभिक्रिया में अभिकारकों में मैग्नीशियम (Mg) के परमाणुओं की संख्या 2 है तथा ऑक्सीजन के परमाणुओं की संख्या भी 2 है और उत्पाद बनने के पश्चात् भी इनकी संख्या उतनी ही रहती है। अतः अभिक्रिया से पूर्व एवं अभिक्रिया के पश्चात् Mg तथा 0, का द्रव्यमान समान रहता है।
अन्य उदाहरण-
अभिक्रिया-
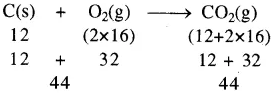
में ऑक्सीजन की उपस्थिति में कोयले का दहन हो रहा है। यहाँ कोयला (C) तथा ऑक्सीजन (O2) अभिकारक हैं । इस अभिक्रिया में 12 ग्राम कार्बन 32 ग्राम ऑक्सीजन से क्रिया करके 44 ग्राम कार्बन डाई ऑक्साइड बनाता है। इससे सिद्ध होता है कि अभिकारकों का कुल द्रव्यमान उत्पादों के कुल द्रव्यमान के समान रहता है।
प्रश्न 3. अम्ल तथा क्षार के मध्य अभिक्रिया को क्या कहते हैं ? विभिन्न प्रकार के अम्लों एवं क्षारों के मध्य अभिक्रिया का वर्णन करते हुए विलयन की pH बताइए।
अथवा
उदासीनीकरण अभिक्रिया किसे कहते हैं? उदाहरण सहित विस्तार से समझाइए।
उत्तर-
जब अम्ल एवं क्षार अभिक्रिया करते हैं और लवण तथा जल बनता है, तो इस अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं। इस अभिक्रिया में अम्ल के हाइड्रोजन आयन (H+) क्षार के हाइड्रॉक्सिल आयन (OH-) से अभिक्रिया करके जल का निर्माण करते हैं।
अम्ल + क्षार → लवण + जल
(a) प्रबल अम्ल तथा प्रबल क्षार के मध्य अभिक्रिया- जब समान सान्द्रता के प्रबल अम्ल एवं प्रबल क्षार क्रिया करते हैं तो प्राप्त विलयन की pH 7 होती है। क्योंकि अम्ल एवं क्षार मिलाने पर विलयन उदासीन होता है। इस अभिक्रिया में अम्ल से प्राप्त एक मोल H+ आयन क्षार के एक मोल OH- आयनों से क्रिया कर जल बनाते हैं अतः विलयन उदासीन हो जाता है। प्रबल अम्ल एवं प्रबल क्षार पूर्णतः आयनित होते हैं।
उदाहरण-
HCl + NaOH → NaCl + H2O
H+ + Cl– + Na+ + OH– → Na+ + Cl– + H2O
कुल अभिक्रिया इस प्रकार होती है
H+ + OH– → H2O
(b) दुर्बल अम्ल तथा प्रबल क्षार के मध्य अभिक्रिया- दुर्बल अम्ल तथा प्रबल क्षार के मध्य होने वाली उदासीनीकरण अभिक्रिया में दुर्बल अम्ल पूर्णतः आयनित नहीं होता है अतः अम्ल एवं क्षार के समान मोल लेने पर भी OH- आयनों की मात्रा H+ आयनों से अधिक होती है अतः उदासीनीकरण अभिक्रिया के पश्चात् भी विलयन में OH- आयन स्वतंत्र अवस्था में पाए जाते हैं अतः विलयन की pH 7 से अधिक होती है।
उदाहरण-
CH3COOH दुर्बल अम्ल + NaOH प्रबल क्षार ⇔ CH3COONa + H2O
CH3COOH + Na+ OH– ⇔ CH3COO–Na+ + H2O
CH3COOH + OH– ⇔ CH3COO– + H2O
(c) प्रबल अम्ल तथा दुर्बल क्षार के मध्य अभिक्रिया- प्रबल अम्ल तथा दुर्बल क्षार के मध्य उदासीनीकरण अभिक्रिया में दुर्बल क्षार पूर्णतः आयनित नहीं होता है। अतः विलयन में अम्ल तथा क्षार के समान मोल लेने पर भी H+ आयनों की मात्रा OH- आयनों की मात्रा से अधिक होती है अतः उदासीनीकरण अभिक्रिया के पश्चात् भी विलयन में H+ आयन स्वतंत्र अवस्था में पाए जाते हैं इसलिए विलयन की pH 7 से कम होती है।
HCl प्रबल अम्ल + NH4OH दुर्बल क्षार → NH4Cl + H2O
H+Cl– + NH4OH + NH4+Cl– + H2O
H+ + NH4OH + NH4+ + H2O
We hope the given Solutions for Class 10 Science Chapter 6 रासायनिक अभिक्रियाएँ एवं उत्प्रेरक will help you. If you have any query regarding Rajasthan Board RBSE Class 10 Science Chapter 6 रासायनिक अभिक्रियाएँ एवं उत्प्रेरक, drop a comment below and we will get back to you at the earliest.
कक्षा 10 का दोहरान करने के लिए नीचे विज्ञान पर क्लिक करें
CLICK HERE FOR ALL CLASS STUDY MATERIAL 2021
SOME USEFUL POST FOR YOU
⇓ ⇓ ⇓
- Posts not found
-
BSER/RBSE 2021 SYLLABUS MODEL PAPERS
-
BSER / RBSE 2021SYLLABUS MODEL PAPERS 2
-
RBSE / BSER TIME TABLE BORD EXAM 2020-21
-
ORDERS AND CIRCULARS OF JANUARY 2021
-
ORDERS AND CIRCULAR OF 2021
-
STUDY MATERIALS FOR 2021
-
EDUCATIONAL ORDERS AND CIRCULARS OF DECEMBER 2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF NOVEMBER 2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF OCTOBER 2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF SEPTEMBER -2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF AUGUST-2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF JULY -2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF MAY -2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF APRIL-2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF MARCH -2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF FEBRUARY -2020
-
EDUCATIONAL ORDERS AND CIRCULARS OF JANUARY-2020
-
RBSE / BSER CLASS 1 TO 12 ALL BOOKS 2021
-
RBSE / BSER BOOKS FOR CLASS 12 SESSION 2021
-
RBSE / BSER BOOKS FOR CLASS 11 SESSION 2021
- Posts not found
- Posts not found